药物医治(化疗、靶向或免疫药物)是很重要的癌症医治办法。可是跟着用药时刻的推移,癌细胞简直会对一切药物发生耐药性,最终导致医治失利。多药耐药ABC转运蛋白介导的药物外排是一种常见的癌细胞耐药机制。ABC转运蛋白具有广泛的底物谱,可以从细胞外排许多外源性化学物质,包含长春花生物碱、鬼臼素、蒽环类药物、紫杉烷类和激酶抑制剂等。因而,在一线临床化疗进程中,因为它们对药物的外排,使得医治作用大大削弱乃至消失。
人类ABC转运蛋白C亚宗族成员ABCC3(亦称多药耐药蛋白MRP3)广泛表达于各种安排,如肾上腺、肝脏、胰腺、胆囊和小肠。其具有广泛的底物特异性,除了转运外源药物而导致耐药性,还可以运送各种内源代谢物,如葡萄糖醛酸胆红素、胆汁酸和类固醇激素。因而,ABCC3参加体内多种生理进程,与人类疾病亲近相关,例如胆汁酸和雌激素在细胞内堆集导致的妊娠期肝内胆汁淤积 (ICP)。
近来,我国科学技能大学生命科学与医学部陈宇星教授和周丛照教授课题组,使用单颗粒冷冻电镜技能解析了人类ABCC3无配基结合 (apo-form)以及生理底物—葡萄糖醛酸雌二醇 (E217βG) 和硫酸脱氢表雄酮 (DHEAS) 结合的蛋白质结构,全体分辨率别离为3.1、3.7和3.5Å。依据蛋白质结构剖析以及生化剖析的成果,作者发现ABCC3具有一个双亲性的底物结合口袋,两个组合的激素分子以不对称方法占有该底物口袋。结合曾经的文献报导,作者提出了同类多药耐药蛋白底物结合口袋的一起特征,为合理规划MRPs的抑制剂供给了方向。相关研讨成果以 “Placing steroid hormones within the human ABCC3 transporter reveals a compatible amphiphilic substrate-binding pocket” 为题于2023年7月24日在线宣布在《TheEMBO Journal》上。
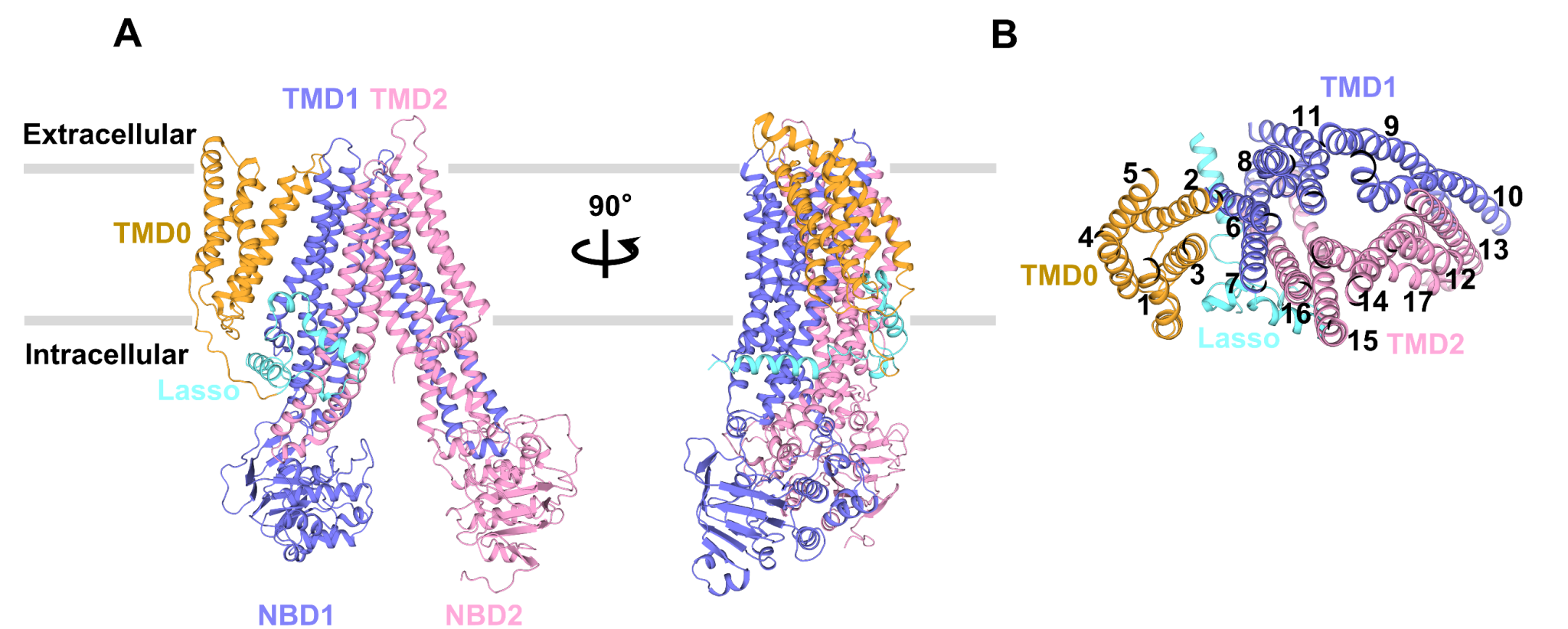
结构剖析标明,apo-form ABCC3结构出现向细胞质基质开口 (inward-facing) 的构象:两个核苷酸结合结构域 (NBD) 互相分隔,两个跨膜结构域 (TMD) 构成一个朝向细胞质基质敞开的“V形”底物转运通道。与经典的ABC转运蛋白不同,其N端有一个额定的五股跨膜螺旋组成的TMD0结构域。TMD0的五股跨膜螺旋靠拢在一起,构成一个紧凑而独立的结构域(图1)。TMD0上的第二股跨膜螺旋(transmembrane helix, TM)TM2经过与TMD1上的TM6构成一个约1700Å2的彼此作用界面,从而与中心结构域彼此作用。但检测ABCC3的ATP水解酶活性以及放射性底物转运试验标明,TMD0结构域对ABCC3的转运功用并不是有必要的,估测其可能会影响ABCC3在极化细胞上的定位或许与其它蛋白有彼此作用。
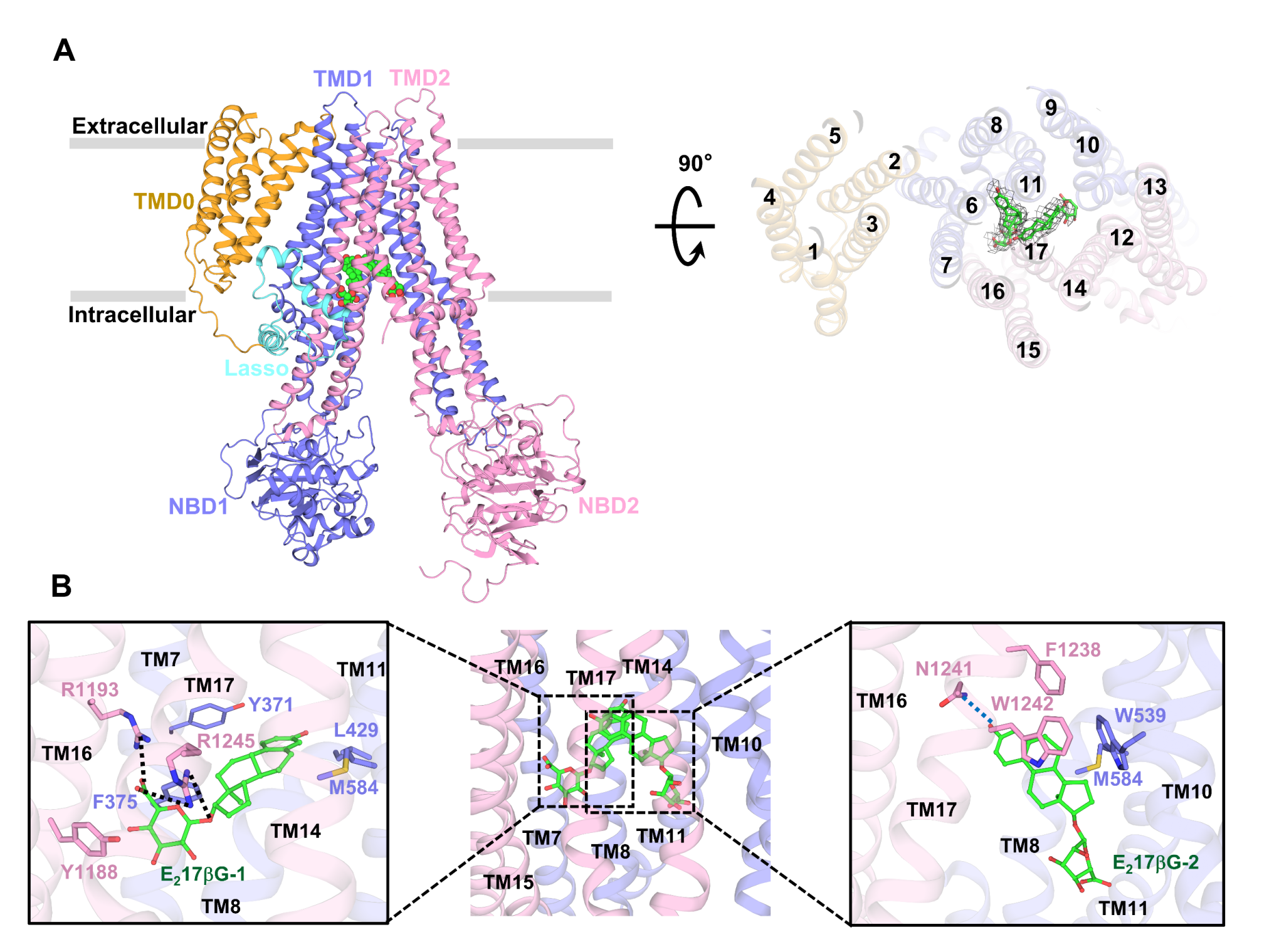
结合底物E217βG的ABCC3依然选用inward-facing构象,底物口袋要害残基的部分重排协助E217βG分子的结合与固定。在该结构中,两个E217βG分子在空间中以“V型”协同结合在ABCC3内部。其间E217βG分子的疏水甾核占有疏水口袋汇并聚成“V型”的极点,两个亲水的葡萄糖醛酸基团别离坐落TMD1和TMD2两边的碱性残基构成的极性口袋中(图2)。生化试验标明,坐落TMD1一侧的两个碱性残基Arg1193和Arg1245关于E217βG分子的结合非常要害,它们的骤变会导致底物影响的ATP酶活性彻底消失,标明精氨酸的长侧链以及强碱性关于底物的结合是必要的。
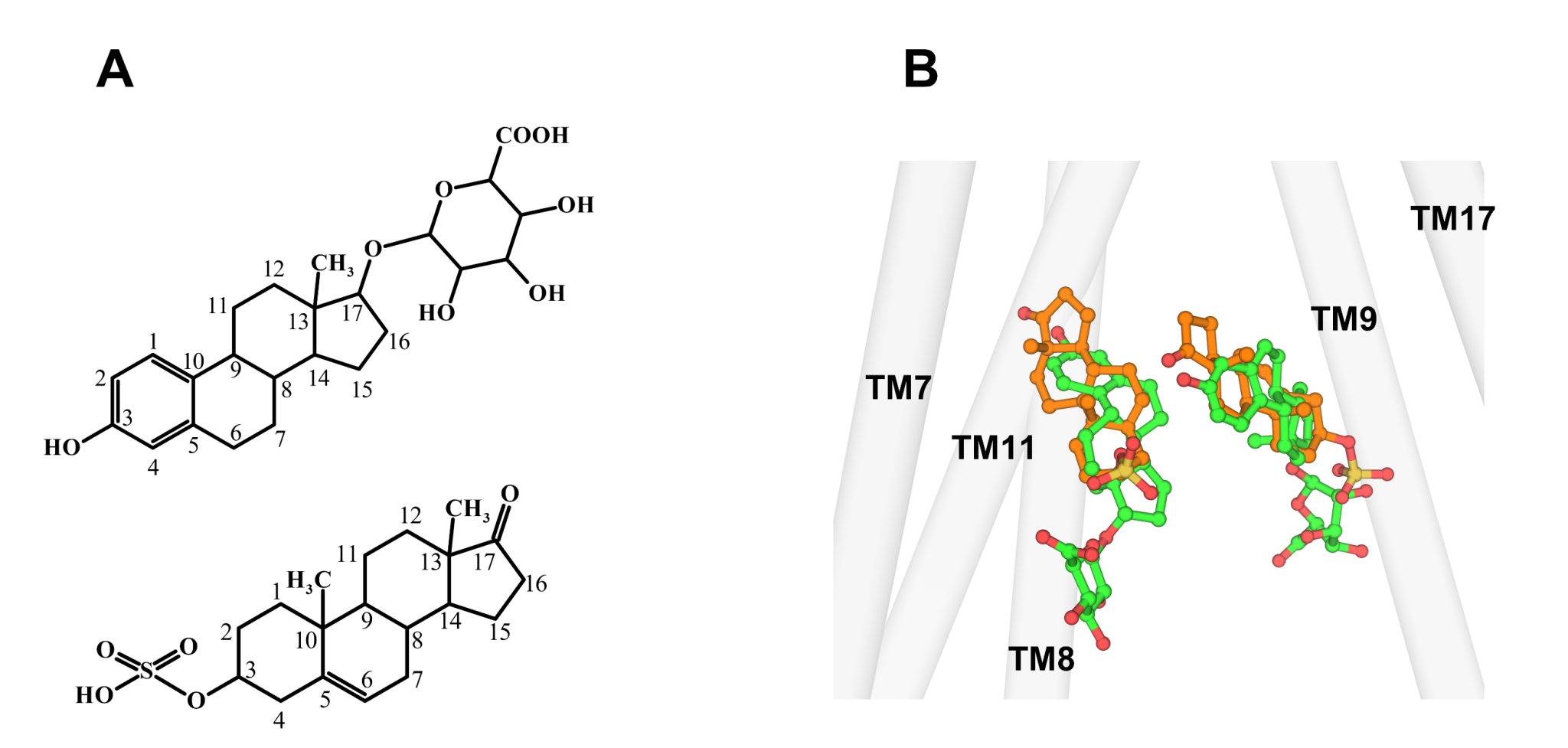
虽然DHEAS和E217βG具有一个相似的疏水甾核,但E217βG的葡萄糖醛酸基团坐落甾核的17′号位,而DHEAS的磺酸基坐落甾核的3′位。在DHEAS结合的ABCC3结构中,有相似的“V型”结合形式(图3),但与E217βG比较, DHEAS分子的甾核出现相反方向,从而使磺酸基也可以占有在TMD1和TMD2两边的碱性口袋。 其磺酸基与TMD1上保存的两个精氨酸Arg1193与Arg124构成盐键,生化活性试验标明这些极性彼此作用对DHEAS的辨认非常重要。
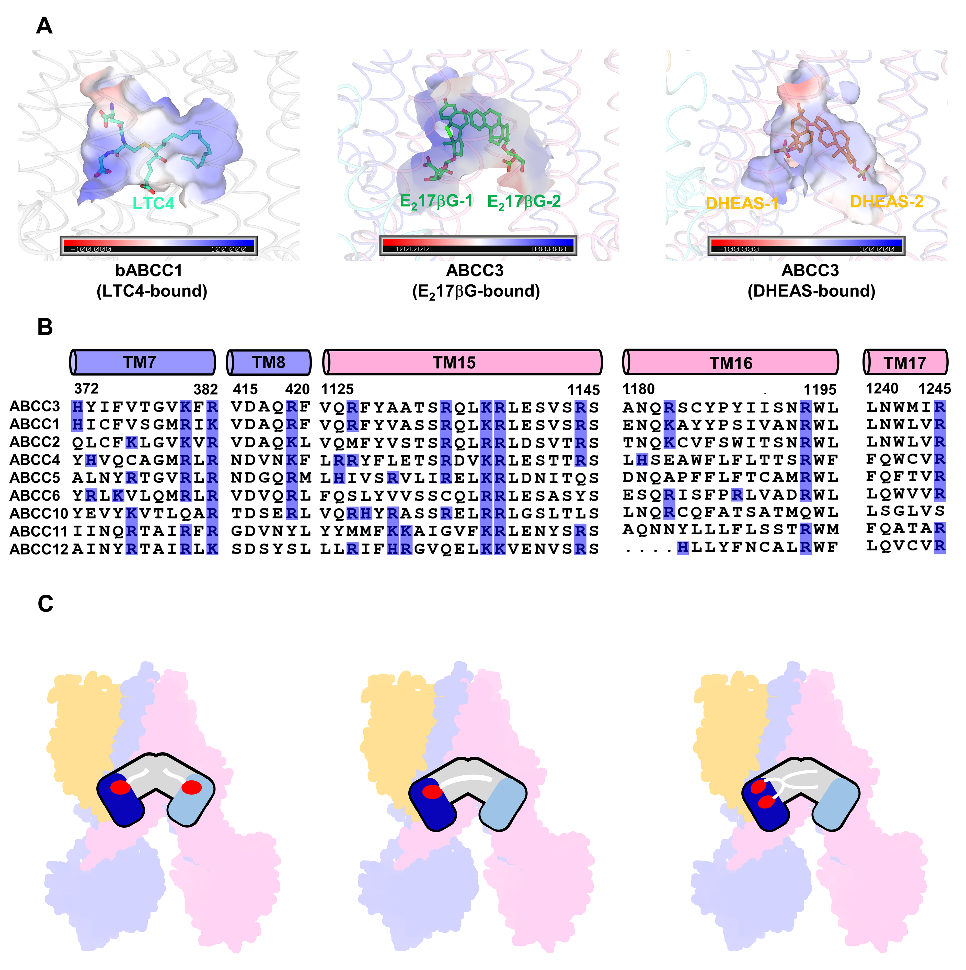
作者进一步剖析了已报导的MRPs结构及其底物,发现它们都具有一个带负电荷的基团组合到疏水的中心结构。ABCC3的底物结合口袋除了具有两个正电的亲水区域外,还有一个较大的疏水腔,因而正好符合底物的彼此结合。TMD1一侧存在一簇碱性残基且在MRPs中高度保存;比较较之下坐落TMD2一侧的亲水区域的正电性较弱且保存性较差。因而,作者依据底物的巨细以及组合方法的不同,将MRPs的底物分为三类,并提出对应的底物结合方法(图4)。总归,该研讨不只阐明晰ABCC3特异性辨认底物的分子机制,并且还提出了一切MRPs一起的底物结合形式,进一步拓宽了咱们对多药耐药分子机制的了解。
我国科学技能大学陈宇星教授、周丛照教授和侯文韬副教授为该论文的一起通讯作者,博士生王洁为该论文的榜首作者。冷冻电镜数据搜集作业在我国科学院北京生物物理研讨所和我国科学技能大学集成印象中心完结。该研讨得到了科技部、国家自然科学基金委、我国科学院和我国科学技能大学等组织的赞助。